Защитный
колпачок
Картридж
с раствором
рФСГч
Держатель
картриджа
Указатель
установленной
дозы
Селектор
дозы
Спусковая
кнопка


Три формы выпуска
шприц-ручки
300 МЕ, 450 МЕ
и 900 МЕ

Точный
минимальный шаг
изменения дозы
5 МЕ

БИОАНАЛОГ –
экономически
предпочтителен
Эффективность и безопасность:
доказана в ходе двух
клинических исследований

Производство в России
в соответствии
со стандартами GMP
О препарате
ПРИМАПУР®
Результаты клинических
исследований
| Примапур® N=55 | Гонал-ф® N=55 | |
|---|---|---|
| Возраст, лет | 31,3 ± 2,68 | 30,0 ± 2,71 |
| ИМТ, кг/м2 | 22,0 ± 2,69 | 22,3 ± 3,06 |
| Продолжительность бесплодия, мес | 46,4 ± 32,4 | 36,9 ± 26,6 |
| Число антральных фолликулов | 11,2 ± 3,2 | 12,4 ± 2,4 |
| АМГ, нг/мл | 4,57 ± 2,96 | 5,47 ± 3,82 |
| ФСГ, МЕ/л | 6,46 ± 1,86 | 6,76 ± 1,89 |
| Эстрадиол, пг/мл | 35,87 ± 12,67 | 33,82 ± 12,45 |
| Причина бесплодия: | ||
| Трубное бесплодие | 21 (38,2%) | 18 (32,7%) |
| Мужской фактор | 21 (38,2%) | 27 (49,1%) |
| Трубное+мужской фактор | 13 (23,6%) | 10 (18,2%) |
* Достоверность различия оценивали по U-критерию Уитни-Манна. Различия между группами статистически не достоверны.
ПРИМАПУР® — лекарственный препарат фолликулостимулирующего гормона (ФСГ). Регулирует рост фолликулов в яичниках, аналогично действию ФСГ, вырабатываемого в организме женщины. Используется в программах вспомогательных репродуктивных технологий и стимуляции овуляции. Применяется только по назначению лечащего врача.
Препарат ПРИМАПУР® выпускается в одноразовых предварительно заполненных шприц-ручках для самостоятельного введения на 300 МЕ, 450 МЕ и 900 МЕ.
| Популяция | ITT (n=110) | |
|---|---|---|
| Примапур® (среднее±СО), N=55 | 12,16±7,28 | |
| Гонал-ф® (среднее±СО), N=55 | 11,62±6,29 | |
| Разность между средними значениями (среднее±СО) |
0,546±1,297 | |
| Достоверность эквивалентности* | 0,002 | |
| 95% доверительный интервал разности между средними значениями |
Нижняя граница Нижняя граница |
-2,026 3,116 |
| Ооциты (MII стадия) |
Оплодотворенные ооциты (2PN) |
Общая доза введенного ФСГ (МЕ) |
|
|---|---|---|---|
| Примапур® (среднее±СО), N=55 | 9,64±6,27 | 8,13±6,61 | |
| Гонал-ф® (среднее±СО), N=55 | 9,86±5,55 | 8,76±5,85 | |
| Разность между средними значениями (среднее±СО) |
0,218±1,129 | 0,636±1,190 | |
| Достоверность различия между средними* |
0,617 | 0,445 | |
| 95% доверительный интервал разности между средними значениями |
Нижняя граница Нижняя граница |
-2,455 2,019 |
-2,995 1,723 |
| Ооциты (MII стадия) |
Дней стимуляции |
||
|---|---|---|---|
| Примапур® (среднее±СО), N=55 | 1532,7±267,2 | 9,75±1,08 | |
| Гонал-ф® (среднее±СО), N=55 | 1517,9±255,2 | 9,73±1,03 | |
| Разность между средними значениями (среднее±СО) |
14,9±49,8 | 0,018±0,201 | |
| Достоверность различия между средними* |
0,488 | 0,629 | |
| 95% доверительный интервал разности между средними значениями |
Нижняя граница Нижняя граница |
-83,9 113,6 |
-0,379 0,416 |
| Популяция РР (с переносом эмбриона в свежем цикле) N=98 |
Частота наступления биохимической беремен- ности (уровень чХГ≥ 25 мЕд/мл, 12-17 день после ПЭ), n (%) |
Частота наступления клини- ческой беременности (наличие плодного яйца+сердцебиение, 10 неделя после ПЭ), n (%) |
|---|---|---|
| Примапур® (среднее±СО), N=55 | 17 (34.7%) [21.4; 48.0%] |
13 (26.5%) [14.1; 38.9%] |
| Гонал-ф® (среднее±СО), N=55 | 18 (36.7%) [23.2; 50.2%] |
16 (32.7%) [19.6; 45.8%] |
| Разность [95% довери- тельный интервал] |
-2.0% [-21.0; 17.0%] |
-0.62% [-24.3; 11.9%] |
| p-value** Χ2 | 0.833 | 0.507 |
| Популяция РР (с переносом эмбриона в свежем цикле) N=98 |
Роды живым плодом, n (%) |
Число рожденных детей, n (%) |
|---|---|---|
| Примапур® (среднее±СО), N=55 | 13 (26.5%) [14.1; 38.9%] |
14 (28.6%) [16.0; 41.3%] |
| Гонал-ф® (среднее±СО), N=55 | 12 (24.5%) [12.5; 36.5%] |
13 (26.5%) [14.1; 38.9%] |
| Разность [95% довери- тельный интервал] |
2.00% [-15.3; 19.3%] |
2.10% [-15.6; 19.8%] |
| p-value** Χ2 | 0.817 | 0.816 |
* Достоверность различия по U-критерию Уитни-Манна. Различия статистически недостоверны. ** Достоверность различия оценивали по U-критерию Уитни-Манна. Различия между группами статистически не достоверны.
ПРОИЗВОДИТЕЛЬ:
Форма выпуска – предварительно заполненные
одноразовые шприц-ручки:
ООО «Завод Медсинтез»
624130, Свердловская обл., г. Новоуральск,
ул. Торговая, д. 15, стр. 3.
Тел/факс: +7 (34370) 2-54-95
ПРОИЗВОДИТЕЛЬ:
Форма выпуска – флаконы:
Филиал «Медгамал» ФГБУ “НИЦЭМ им. Н.Ф. Гамалеи”
Минздрава России
123098 Москва, ул. Гамалеи, д. 18
Тел. +7 (499)190-44-78,
факс +7 (499) 190-66-71


Результаты 5484 циклов овариальной стимуляции в 2020 году


Мета-анализ клинических исследований, включая Примапур®

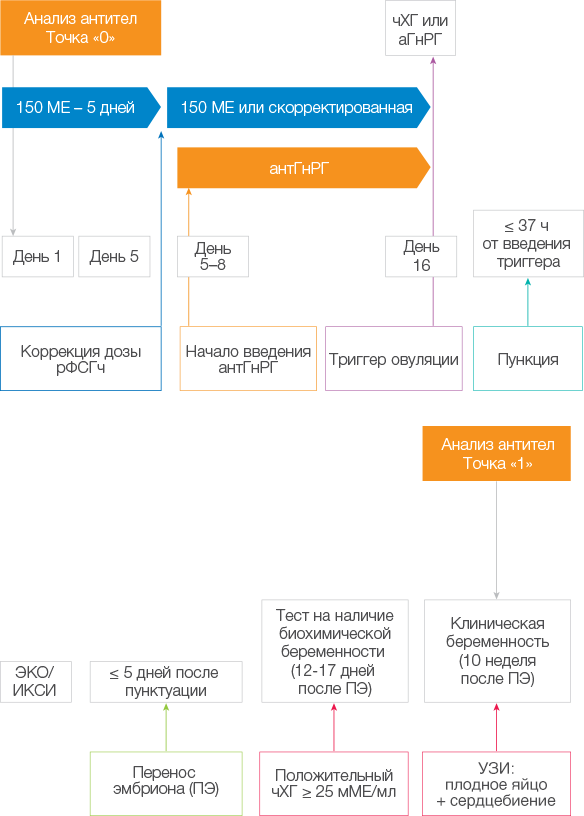
В 2020 году в России было проведено исследование «ФОЛЛИТРОПИН»:
«Применение биоаналогового препарата рекомбинантного человеческого ФОЛЛикулостимулирующего гормона в цИклах эксТРакорпорального ОПлодотворения: наблюдательное Исследование в условиях реальНой клинической практики»(сайт исследования http://www.follitropin.ru ).
Протокол исследования и результаты доступны в международной базе ClinicalTrials.gov (NCT04854707)


Исследование «ФОЛЛИТРОПИН» является самым масштабным ретроспективным наблюдательным исследованием, проведенным в России в области репродуктивного здоровья человека и охватывает анализ 5484 циклов овариальной стимуляции, проведенных в 35 клиниках ВРТ в 2020 году.
Ретроспективное, неинтервенционное (наблюдательное), анонимное, когортное исследование эффективности и безопасности применения биоаналогового фоллитропина альфа (Примапур®), применяемого в соответствии с показаниями, указанными в действующей утвержденной инструкции по медицинскому применению.
Пациентки с показаниями к применению методов ВРТ, проходящие лечение бесплодия в специализированных клиниках репродукции человека. Причина бесплодия: первичное и вторичное бесплодие (бесплодие I и II), а также доноры ооцитов.
35 клиник репродукции человека во всех федеральных округах России.
Монопрепарат Примапур® (монотерапия); смешанные протоколы овариальной стимуляции (рекомбинантные и мочевые гонадотропины); короткие протоколы с использованием антагонистов гонадотропин-рилизинг гормона (антГнРГ); длинные протоколы с использованием агонистов гонадотропин-рилизинг гормона (аГнРГ).
| Протоколы овариальной стимуляции | N (%) |
|---|---|
| Количество анализируемых циклов овариальной стимуляции, с использованием препарата Примапур®: | 5484 (100) |
| • из них, циклов с использованием антагонистов ГнРГ | 4328 (78,9) |
| • из них, циклов с использованием агонистов ГнРГ | 1156 (21,1) |
| Монотерапия с применением только препарата Примапур® | 2859 (52,1) |
| Смешанные протоколы, где Примапур® использовался минимум 5 дней совместно с другими гонадотропинами: | 2625 (47,9) |

Примапур® и Менопур®
|
1971 (35,9) |

Примапур® и Элонва®
|
264 (4,8) |

Примапур® и Перговерис®
|
106 (1,9) |

Примапур® и Гонал-Ф®
|
81 (1,5) |

Примапур® и Пурегон®
|
75 (1,4) |

Примапур® и Менопур® и Элонва®
|
47 (0,9) |

Примапур® и Менопур® и Гонал-Ф®
|
46 (0,8) |

Примапур® и Менопур® и Пурегон®
|
27 (0,5) |

Примапур® и Менопур® и Перговерис®
|
8 (0,2) |
Рекомбинантные гонадотропины: Примапур®, Гонал-Ф®: фоллитропин альфа Пурегон®: фоллитропин бета Элонва®: корифоллитропин альфа Перговерис®: фоллитропин альфа+лутропин альфа Мочевые гонадотропины: Менопур®: менотропин.

ВЫВОДЫ

Из 5484 циклов было проведено 4328
(или 78,9% от анализируемых) циклов коротких протоколов с использованием антагонистов гонадотропного рилизинг-гормона (антГнРГ), 1156 циклов (21,1%) с использованием агонистов гонадотропного рилизинг-гормона (аГнРГ).

Препарат Примапур® в виде монотерапии
применялся при проведении 2859 циклов овариальной стимуляции (52,1% от проведенных протоколов). Совместно с другими гонадотропинами Примапур® применялся в 2625 циклах (47,9%).

Основным сопутствующим препаратом
для проведения стимуляции с использованием смешанного протокола у 1971 пациентки (в 35,9 % случаев) использовался менотропин. Также у 264 пациенток (4,8% случаев) Примапур® применялся совместно с корифоллитропином альфа, у 106 пациенток (1,9 %) – совместно с фиксированной комбинацией рекомбинантного фоллитропина альфа+лутропина альфа.
| Параметр | Все протоколы овариальной стимуляции с использованием Примапур® N=5484 | Смешанные протоколы N=2625 |
|---|---|---|
| Возраст, лет (среднее±СО) | 33,9±4,8 | 34,9±4,8 |
| Рост, см (среднее±СО) | 165,3±6,3 | 165,6±6,2 |
| Вес, кг (среднее±СО) | 65,1±15,6 | 65,5+-13,1 |
| ИМТ, кг/м2 (среднее±СО) | 23,8±5,7 | 23,9±4,7 |
| Продолжительность бесплодия, лет (среднее±СО) | 5,6±4,2 | 5,7±4,1 |
| Попытка ЭКО, n (среднее ±СО) | 1,3±0,7 | 1,4±0,7 |
| Причина бесплодия, % | ||
| • Бесплодие I | 47,1 % | 47,9 % |
| • Бесплодие II | 40,1 % | 41,9 % |
| • Доноры ооцитов | 12,8 % | 10,2 % |
| Параметр | Монотерапия Примапур® N=2859 | Достоверность различия между средними (p) |
|---|---|---|
| Возраст, лет (среднее±СО) | 32,9±4,7 | <0,001* |
| Рост, см (среднее±СО) | 165,0±6,4 | |
| Вес, кг (среднее±СО) | 64,7±17,6 | |
| ИМТ, кг/м2 (среднее±СО) | 23,6±4.5 | 0,045* |
| Продолжительность бесплодия, лет (среднее±СО) | 5,5±4,2 | 0,164** |
| Попытка ЭКО, n (среднее ±СО) | 1,3±0,6 | <0,001** |
| Причина бесплодия, % | ||
| • Бесплодие I | 46,3 % | |
| • Бесплодие II | 38,5 % | |
| • Доноры ооцитов | 15,2 % |
| Параметр | Монотерапия: короткий протокол (антГнРГ) N=2183 | Монотерапия: длинный протокол (аГнРГ) N=676 |
|---|---|---|
| Возраст, лет (среднее±СО) | 32,9±4,6 | 33,1±4,9 |
| Рост, см (среднее±СО) | 165,0±6,3 | 165,2±6,7 |
| Вес, кг (среднее±СО) | 65,0±18,6 | 63,2±12,9 |
| ИМТ, кг/м2 (среднее±СО) | 23,7±4,6 | 23,1±4,5 |
| Продолжительность бесплодия, лет (среднее±СО) | 5,4±4,3 | 5,6±3,8 |
| Попытка ЭКО, n (среднее ±СО) | 1,2±0,5 | 1,4±0,9 |
| Причина бесплодия, % | ||
| • Бесплодие I | 46,9 % | 38,9 % |
| • Бесплодие II | 39,1 % | 41,9 % |
| • Доноры ооцитов | 14,0 % | 19,2 % |
| Параметр | Достоверность различия между средними (p) |
|---|---|
| Возраст, лет (среднее±СО) | 0,449* |
| Рост, см (среднее±СО) | |
| Вес, кг (среднее±СО) | |
| ИМТ, кг/м2 (среднее±СО) | 0,019* |
| Продолжительность бесплодия, лет (среднее±СО) | 0,403** |
| Попытка ЭКО, n (среднее ±СО) | <0,001** |
| Причина бесплодия, % | |
| • Бесплодие I | |
| • Бесплодие II | |
| • Доноры ооцитов |
* Достоверность различия между группами оценивали по t-критерию ANOVA. Различия статистически достоверны при p<0,05.
** Достоверность различия оценивали по U-критерию Уитни-Манна. Различия статистически достоверны при p<0,05.

ВЫВОДЫ

Пациентки, прошедшие лечение с использованием смешанных протоколов (N=2625), принадлежали к более старшей возрастной группе (p<0,001), повышенный индекс массы тела (ИМТ) (p=0,045), а также большее количество попыток ЭКО/ИКСИ (p<0,001), в сравнении с группой пациенток с монотерапией (N=2859) препаратом Примапур®.

Монотерапию препаратом Примапур® проводили как в коротких протоколах с антГнРГ (N=2183), так и в длинных протоколах с аГнРГ (N=676). Возраст и продолжительность бесплодия достоверно не отличались между анализируемыми группами (p=0,449 и p=0,403, соответственно). В то же время, ИМТ пациенток в группе монотерапии с использованием антГнРГ был статистически значимо выше по сравнению с группой пациенток, использовавших аГнРГ (p=0,019), а попыток ЭКО/ИКСИ было значимо больше в группе с аГнРГ (p<0,001).
| Параметр | Все протоколы овариальной стимуляции с использованием Примапур® N=5484 |
|---|---|
| Пациентки с проведенной овариальной стимуляцией, n (%) | 5484 (100 %) |
| Количество отмененных циклов из-за отсутствия ответа яичников, n (%) | 167 (3,1 %) |
| Количество не проведенных переносов эмбрионов (донорские программы), n (%) | 702 (12,8 %) |
| Пациентки с пункцией фолликулов, n (%) | 5317 (96,9 %) |
| Количество аспирированных ооцитов, n (среднее±СО) | 9,5 ± 7,2 |
| Зрелые ооциты (стадия MII), n (среднее±СО) | 6,8 ± 6,6 |
| Зиготы (2PN), n (среднее±СО) | 6,1 ± 5,8 |
| Общая доза введенного препарата на цикл стимуляции, МЕ (среднее±СО) | 1825 ± 647 |
| Всего переносов эмбриона, n (%) | 4220 (76,9 %) |
| • из них с известным исходом, n (%) | 3342 (60,9 %) |
| Перенесено эмбрионов, n (среднее±СО) | 1,2 ± 0,5 |
| Развивающаяся клиническая беременность на перенос эмбриона (наличие плодного яйца и сердцебиения, от 6 недели после ПЭ), n (% наступления беременности на перенос с известным исходом), 95% ДИ | 1283 (38,4%) |

ВЫВОДЫ

Среднее количество
аспирированных ооцитов составило 9,5±7,2, зрелых (MII): 6,8±6,6, оплодотворенных (2PN): 6,1±5,8, частота наступления клинической беременности на перенос (ЧНБ): 38,4%.

3,1% циклов было отменено из-за отсутствия ответа яичников
на вводимые дозы препаратов, что является сопоставимым с опубликованными мировыми данными.

Был произведен перенос в среднем 1,2±0,5 эмбриона.
| Параметр | Смешанные протоколы N=2625 | Монотерапия Примапур® N=2859 | Достоверность различия между средними (p) |
|---|---|---|---|
| Пациентки с проведенной овариальной стимуляцией, n (%) | 2625 (100 %) | 2859 (100 %) | |
| Количество отмененных циклов из-за отсутствия ответа яичников, n (%) | 78 (3,0 %) | 89 (3,1 %) | |
| Количество не проведенных переносов эмбрионов (донорские программы), n (%) | 267 (10,2 %) | 435 (15,2 %) | |
| Пациентки с пункцией фолликулов, n (%) | 2547 (97,0 %) | 2770 (96,9 %) | |
| Количество аспирированных ооцитов, n (среднее±СО) | 8,6 ± 6,8 | 10,3 ± 7,4 | <0,001* |
| Зрелые ооциты (стадия MII), n (среднее±СО) | 6,7 ± 6,2 | 7,7 ± 6,9 | <0,001* |
| Зиготы (2PN), n (среднее±СО) | 5,8 ± 5,2 | 7,2 ± 6,2 | <0,001* |
| Общая доза введенного препарата на цикл стимуляции, МЕ (среднее±СО) | 1672 ± 568 | 1919 ± 639 | <0,001* |
| Всего переносов эмбриона, n (%) | 2007 (76,5 %) | 2213 (77,4 %) | |
| • из них с известным исходом, n (%) | 1542 (58,7 %) | 1800 (63,0 %) | |
| Перенесено эмбрионов, n (среднее±СО) | 1,2 ± 0,6 | 1,2 ± 0,4 | |
| Развивающаяся клиническая беременность на перенос эмбриона (наличие плодного яйца и сердцебиения, от 6 недели после ПЭ), n (% наступления беременности на перенос с известным исходом), 95% ДИ | 606 (39,3 %) 95% ДИ [36,9%- 41,7%] |
677 (37,6%) 95% ДИ [35,3%- 39,8%] |
0,314** |
*Достоверность различия оценивали по U-критерию Уитни-Манна. Различия статистически достоверны при p<0,05.
**Достоверность различия между пропорциями в выборках проводили с помощью Z-критерия, методом Клоппера-Пирсона.
Различия статистически достоверны при p<0,05.

ВЫВОДЫ

Анализ смешанных циклов (N=2625):
Среднее количество аспирированных ооцитов составило 8,6±6,8, зрелых (MII): 6,7±6,2, оплодотворенных 5,8±5,2, ЧНБ 39,3% [95% ДИ: 36,9-41,7%], 3,0% отмененных циклов.

Анализ циклов с монотерапией препаратом Примапур® (N=2859):
Среднее количество аспирированных ооцитов составило 10,3±7,4, зрелых 7,7±6,9, оплодотворенных 7,2±6,2 , ЧНБ 37,6% [95% ДИ: 35,3-39,8%], 3,1% отмененных циклов.
Среднее количество аспирированных, зрелых ооцитов, правильно оплодотворенных - статистически значимо выше в группе с монотерапией препаратом Примапур®, чем при применении смешанных протоколов (p<0,001), ввиду отличий в популяции пациенток в сравниваемых группах: статистически значимые различия в возрасте, ИМТ и попыткам ЭКО/ИКСИ не в пользу группы со смешанной терапией.
Вероятность достоверности различий ЧНБ на произведенный перенос не является статистически значимой между группами и составила p=0,314.
| Параметр | Монотерапия: короткий протокол (антнРГ) N=2183 | Монотерапия: длинный протокол (аГнРГ) N=676 | Достоверность различия между средними (p) |
|---|---|---|---|
| Пациентки с проведенной овариальной стимуляцией, n (%) | 2183 (100 %) | 676 (100 %) | |
| Количество отмененных циклов из-за отсутствия ответа яичников, n (%) | 59 (2,7 %) | 30 (4,4 %) | |
| Количество не проведенных переносов эмбрионов (донорские программы), n (%) | 305 (14,0%) | 130 (19,2 %) | |
| Пациентки с пункцией фолликулов, n (%) | 2124 (97,3 %) | 646 (95,6 %) | |
| Количество аспирированных ооцитов, n (среднее±СО) | 10,5 ± 7,5 | 9,6 ± 7,0 | 0,032* |
| Зрелые ооциты (стадия MII), n (среднее±СО) | 7,6 ± 6,9 | 6,7 ± 5,7 | <0,001* |
| Зиготы (2PN), n (среднее±СО) | 7,3 ± 6,3 | 5,7 ± 5,0 | <0,001* |
| Общая доза введенного препарата на цикл стимуляции, МЕ (среднее±СО) | 1952 ± 621 | 1711 ± 680 | <0,001* |
| Всего переносов эмбриона, n (%) | 1809 (82,9 %) | 404 (59,8 %) | |
| • из них с известным исходом, n (%) | 1466 (67,2 %) | 334 (49,4 %) | |
| Перенесено эмбрионов, n (среднее±СО) | 1,2 ± 0,5 | 1,2 ± 0,4 | |
| Развивающаяся клиническая беременность на перенос эмбриона (наличие плодного яйца и сердцебиения, от 6 недели после ПЭ), n (% наступления беременности на перенос с известным исходом), 95% ДИ | 557 (37,9%) 95% ДИ [35,5%-40,5%] |
120 (35,9%) 95% ДИ [30,8%-41,1%] |
0,482** |
*Достоверность различия оценивали по U-критерию Уитни-Манна. Различия статистически достоверны при p<0,05.
**Достоверность различия между пропорциями в выборках проводили с помощью Z-критерия, методом Клоппера-Пирсона.
Различия статистически достоверны при p<0,05

ВЫВОДЫ

Анализ монотерапии и коротких протоколов с применением антГнРГ (N=2183):
Среднее количество аспирированных ооцитов составило 10,5±7,5, зрелых 7,6±6,9, оплодотворенных 7,3±6,3, ЧНБ 37,9% [95% ДИ: 35,5-40,5%], 2,7% отмененных циклов.

Анализ монотерапии и длинных протоколов с применением аГнРГ (N=676):
Среднее количество аспирированных ооцитов составило 9,6±7,0, зрелых 6,7±5,7, оплодотворенных 5,7±5,0, ЧНБ 35,9% [95% ДИ: 30,8-41,1%], 4,4% отмененных циклов.
Среднее количество аспирированных, зрелых ооцитов, правильно оплодотворенных - статистически значимо выше в группе с монотерапией и антГнРГ, чем при применении агГнРГ (p<0,001). Описанное отличие подтверждается известными данными о том, что овариальная стимуляция с применением антГнРГ приводит к большему количеству получаемых ооцитов в сравнении с циклами с использованием аГнРГ из-за различий в стимуляции к росту синхронизованной по размеру когорте фолликулов.
Вероятность достоверности различий ЧНБ на произведенный перенос не является статистически значимой между группами и составила p=0,482.
История
создания
препарата

Запатентованные изобретения –
клетки-продуценты, состав препарата
и шприц-ручка – созданы в сотрудничестве
с Российской академией наук
Структурные исследования молекулы – проведены
в России, Великобритании, Германии, Израиле и Франции
Клинические исследования препарата Примапур® –
проведены в России
Производство в России в соответствии
со стандартами GMP
Как применять
шприц-ручку
Шприц-ручка КомфортПен®
одноразовая предварительно заполненная препаратом ПРИМАПУР®

пациентов
назвали шприц-ручку
удобной

Диапазон выбора
однократной дозы –
от 5 до 300 МЕ

Индивидуальный
подход –
минимальный
шаг 5 МЕ

Три формы выпуска
шприц-ручки
300 МЕ, 450 МЕ
и 900 МЕ

зарегистрирована
в Росздравнадзоре
в качестве
медицинского изделия

Точность –
соответствует
требованиям
ISO 11608-1:2014(E)

Состав предварительно заполненной шприц-ручки одноразовой.
Перед первым использованием обязательно внимательно изучите состав шприц-ручки.
держатель
картриджа
поршень
картриджа
указатель
установленной
дозы
селектор
дозы
защитный
колпачок
резиновый
диск
картридж
шкала
остатка
окно селектора
дозы
спусковая
кнопка


Подготовка к применению шприц-ручки
Убедитесь в том, что у Вас есть все необходимое для проведения инъекции.
Для проведения инъекции Вам
необходимы:
- предварительно заполненная
шприц-ручка одноразовая, содержащая
препарат Примапур®
- дезинфицирующее средство
и стерильный ватный тампон
или спиртовой ватный тампон
- контейнер для утилизации
использованных игл и других расходных
материалов

Тщательно вымойте руки с мылом и вытрите
их насухо чистым полотенцем.

Возьмите упаковку препарата Примапур® из
холодильника и достаньте шприц-ручку из
упаковки.
Подержите шприц-ручку несколько минут
(5-10 мин) перед использованием при
комнатной температуре (не более 25 °С).
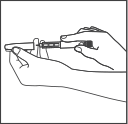
Потяните защитный колпачок предварительно
заполненной шприц-ручки,
чтобы снять его.
Не снимайте этикетку со шприц-ручки.
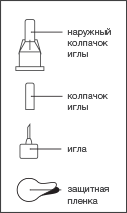
Возьмите новую иглу из упаковки,
снимите только защитную пленку,
не снимая двух защитных колпачков.
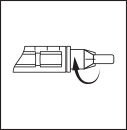
Прикрутите иглу, не снимая защитных
колпачков, непосредственно к держателю
картриджа до тех пор, пока он прочно
не зафиксируется.
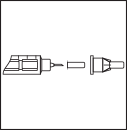
Снимите внешний, затем внутренний
колпачки иглы. Не выбрасывайте
внешний колпачок – он Вам понадобится
для снятия иглы.


Рекомендации к первому использованию шприц-ручки
Если шприц-ручка не использовалась ранее, то важно подготовить ее к первому использованию,
чтобы удалить крупные пузырьки воздуха из картриджа.
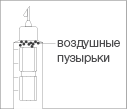
Воздушные пузырьки считаются крупными,
если при удерживании шприц-ручки иглой
вверх они заполняют верхнюю поверхность
картриджа. Если Вы обнаружите такие
пузырьки, то переходите к разделу 4
«Удаление пузырьков из картриджа».
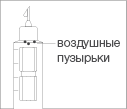
В шприц-ручке может оставаться несколько
мелких воздушных пузырьков, прилипших к
внутренней стенке картриджа. Не обращайте
внимания на мелкие пузырьки, их удалять
необязательно, переходите к разделу 5
«Проведение инъекции». Картридж
шприц-ручки содержит дополнительный
объем лекарственного средства для<
процедуры удаления пузырьков.


Удаление пузырьков из картриджа
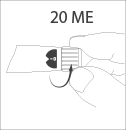
Установите 20 МЕ** на селекторе дозы.
Если Вы установили большее значение, то
просто поверните селектор дозы в обратную
сторону для установления дозы обратно на
отметку 20 напротив указателя установленной
дозы.
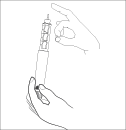
Держите шприц-ручку иглой вверх. Слегка
постучите по держателю картриджа пальцем
так, чтобы все воздушные пузырьки всплыли
вверх к игле.

Продолжая удерживать шприц-ручку иглой
вверх, нажмите спусковую кнопку и
продолжайте давить на нее до тех пор, пока
нулевая отметка в окне селектора дозы не
совместится с указателем на корпусе
шприц-ручки.
Если на кончике иглы появилась капля
жидкости и пузырьки воздуха вышли из
картриджа ручки, то шприц-ручка готова к
использованию.
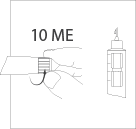
Если после этого на конце иглы не появился
раствор, то набирайте и спускайте по 10 МЕ до
появления раствора на конце иглы, как
описано выше.
** МЕ – Международная Единица


Проведение инъекции
Подготовка места для инъекции
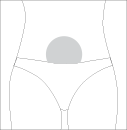
Лечащий врач посоветует, куда именно делать Вам инъекцию препарата. Наиболее подходящее место
для подкожного введения – область живота вокруг пупка с подвижной кожей и прослойкой жировой
клетчатки.
При каждой инъекции следует немного менять место введения.
Подготовленным ватным тампоном протрите примерно 6 см вокруг предполагаемого места введения
иглы и подождите примерно минуту, чтобы дезинфицирующий раствор испарился.
Набор дозы для инъекции
Убедитесь, что указатель на корпусе шприц-ручки
показывает на нулевую отметку в окне селектора дозы.
Наберите с помощью селектора дозы необходимое
количество МЕ, которое должно стоять напротив
указателя установленной дозы.
ВАЖНО
∙ Набор дозы в шприц-ручке может быть изменен
вращением селектора набора дозы в любом
направлении.
∙ Минимальный шаг изменения дозы с помощью
шприц-ручки составляет 5 МЕ, что соответствует
единичному звуковому/тактильному щелчку при
повороте селектора дозы шприц-ручки.
∙ На шкале селектора дозы напротив указателя
установленной дозы отображаются числовые
значения, кратные 10 МЕ, промежуточные дозы,
кратные 5 МЕ, обозначены чертой.
∙ Перед инъекцией убедитесь, что указатель на
корпусе показывает на нужное число МЕ в окне
селектора дозы.
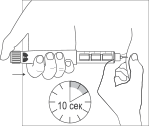
Двумя пальцами сформируйте кожную
складку в месте предполагаемой инъекции.
Введите иглу под углом 900 под поверхность
кожи. Нажмите спусковую кнопку большим
пальцем руки, не касаясь вращающихся
деталей шприц-ручки, в том числе и
селектора дозы.
Продолжайте давить на спусковую кнопку до
тех пор, пока нулевая отметка в окне
селектора дозы не совместится с указателем
установленной дозы на корпусе шприц-
ручки. Посчитайте до 10 и вытащите иглу из
кожи, удерживая спусковую кнопку в
нажатом положении.
Обработайте участок инъекции тампоном,
смоченным дезинфицирующим средством.
Удаление иглы
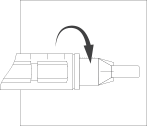
Осторожно наденьте на иглу
внешний колпачок, открутите иглу
от шприц- ручки и выбросьте ее в
контейнер.
ВАЖНО
∙ Если Вы ввели большую дозу, чем требовалось, обратитесь к разделу инструкции «Побочное действие» и «Передозировка», а также обязательно свяжитесь с лечащим врачом.
∙ Если Вы забыли ввести назначенную дозу, то не вводите двойную дозу, обратитесь за советом к лечащему врачу.


Недостаточное количество дозы в шприц-ручке
Если во время инъекции селектор дозы остановится до того, как нулевая отметка совместится с указателем установленной дозы – это означает, что Вы не получили необходимую дозу препарата. При этом селектор дозы показывает число единиц, которое должно быть введено до полной дозы в повторной инъекции.
Для проведения повторной инъекции:
(а) Запишите значение, указанное на селекторе дозы, которое Вы не смогли ввести.
(б) Подготовьте новую шприц-ручку к инъекции, как указано в разделах 2, 3, 4 «Удаление пузырьков воздуха».
(в) Установите на новой подготовленной к инъекции шприц-ручке необходимую записанную дозу для завершения предписанной инъекции.
(г) Проведите инъекцию, следуя рекомендациям в разделе 5 «Проведение инъекции»
Чтобы знать о количестве оставшегося препарата в шприц-ручке, Вам необходимо ежедневно вести дневник лечения (раздел 10 «Пример дневника лечения» и раздел 11 «Дневник лечения»)
Если дозы, оставшейся в шприц-ручке недостаточно, чтобы провести инъекцию, то у Вас есть две возможности:
(1) Ввести дозу, которая осталась в ручке, следуя записям из Дневника лечения, и затем взять новую ручку, подготовить ее к инъекции, установить на ней оставшуюся часть требуемой дозы и ввести ее.
(2) Выбросить старую ручку, взять новую и ввести требуемую дозу.

Меры предосторожности
Предварительно заполненная шприц-ручка одноразовая должна использоваться только после консультации с Вашим лечащим врачом.
Для предотвращения инфицирования шприц-ручка должна использоваться только одним пациентом и не передаваться другому лицу.
В случае загрязнения резинового диска картриджа продезинфицируйте его ватным тампоном с антисептиком, дождитесь полного высыхания диска перед установкой иглы.
Очищайте шприц-ручку влажной тканью. Не погружайте шприц-ручку в воду. Для каждой инъекции используйте только новую иглу.
Сразу после инъекции игла должна быть снята и утилизирована безопасным способом. Если игла останется на шприц-ручке, это может привести к ее засорению и повлиять на точность введения дозы.

Хранение и утилизация
Шприц-ручка должна всегда храниться со снятой иглой и с надетым колпачком.
Шприц-ручки, которые Вы используете в настоящее время, следует хранить при температуре от 2 до 8 °С (в холодильнике), предохранять от прямых солнечных лучей.
Нельзя помещать шприц-ручку в морозильную камеру холодильника, где температура ниже 0 °С.
Храните предварительно заполненные шприц-ручки в местах, недоступных для детей.
Утилизируйте использованные иглы в их защитных колпачках.
Пустые шприц-ручки не должны использоваться повторно.
Утилизируйте использованные шприц-ручки без прикрепленных к ним игл
и в соответствии с рекомендациями лечащего врача.
Дневник
лечения
С самого начала лечения рекомендуется вести дневник лечения, куда необходимо
записывать: день стимуляции овуляции, дату проведенной инъекции, введенную
дозу, остаток содержимого шприц-ручки.
Пример дневника лечения
| День стимуляции | Дата | Содержимое шприц-ручки (МЕ*) |
Дневная доза, введенная при инъекции (МЕ*) |
Остаток в шприц-ручке (МЕ*) |
|---|---|---|---|---|
| 1 | 01.01.2016 | 900 | 150 | 900 – 150 = 750 |
| 2 | 02.01.2016 | 750 | 150 | 750 – 150 = 600 |
Фармаконадзор
Мониторинг безопасности препарата
В соответствии с российским законодательством, международными стандартами и политикой компании в области качества, ООО «АйВиФарма» осуществляет мониторинг безопасности и качества производимых лекарственных препаратов в целях защиты интересов пациентов.
Мы будем благодарны вам за любые дополнительные сведения о переносимости препарата ПРИМАПУР®, выпускаемом в шприц-ручке КомфортПен®.
Если Вам стало известно о нежелательный реакциях при применении лекарственного препарата, выпускаемом в шприц-ручке КомфортПен® или иных событиях, которые могут быть связаны с безопасностью этого препарата, просим Вас сообщить о них удобным для вас способом:
• Заполнить форму
• Сообщить информацию в Отдел безопасности лекарственного
препарата ПРИМАПУР®:
- по электронной почте: npr@ivfarma.ru
- по почте: 117246, г. Москва, Научный проезд, д.20, стр.2,
ООО «АйВиФарма» с пометкой «фармаконадзор»
- по телефону/факсу +7 (499) 645 53 42
Этот раздел сайта содержит информацию о лекарственных препаратах,
отпускаемых по рецепту. Согласно действующему законодательству,
материалы этого раздела могут быть доступны только для медицинских
и фармацевтических работников.
Вы являетесь медицинским или фармацевтическим работником
и согласны с данным утверждением?


Соглашение о получении информации о лекарственных препаратах, отпускаемых порецепту врача.
В данном разделе сайта компания ООО «АйВиФарма» представляет информацию о препаратах, отпускаемых по рецепту врача, их свойствах, способах применения и возможных противопоказаниях исключительно специалистам здравоохранения(медицинские и фармацевтические работники).
В случае, если Вы не являетесь специалистом здравоохранения, но в нарушение настоящего условия подписываете данное соглашение, ООО «АйВиФарма» не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с сайта, без предварительной консультации со специалистом здравоохранения. Вы делаете это самостоятельно и осознанно, понимая, что применение рецептурных препаратов возможно только после предварительной консультации со специалистом здравоохранения.
Настоящим я подтверждаю, что являюсь специалистом здравоохранения и подтверждаю своё согласие с тем, что применение лекарственных препаратов, отпускаемых по рецепту врача, возможно только после предварительной консультации со специалистом.
Если Вы не согласны с данным соглашением, то, к сожалению, мы не можем предоставить Вам доступ к информации данного сайта.

